- elle est bénéfique pour la santé : une eau dure (riche en calcium et en magnésium) couvre un tiers des besoins en calcium et magnésium de l'homme, et assurerait une protection contre les maladies cardiovasculaires. Elle est aussi plus agréable à boire. En outre, une eau carbonatée génère un dépôt sur les parois des canalisations qui la transportent. Ce dépôt peut être utile à faible dose, en assurant notamment une protection contre les risques de corrosion.
- en revanche, elle présente certains inconvénients domestiques, en formant des dépôts blancs (même à l'extérieur des canalisations aux jointures), un dépôt de carbonate sur la vaisselle, les verres, en provoquant des phénomènes d'entartrage des tuyaux et des équipements électroménagers qui utilisent l'eau.
C'est pourquoi le calcaire est, après le goût, le deuxième motif de non-satisfaction des usagers de l'eau du robinet.
Ces inconvénients s'amplifient surtout avec l'eau chauffée. En effet, les dépôts de carbonate (calcaire) sont proportionnels à la température. Plus une eau est chauffée, plus les dépôts sont importants. C'est pourquoi les bouilloires ou machines à café s'entartrent si vite. Par exemple, une couche de 3mm de calcaire sur la résistance d'un ballon d'eau chaude ou d'un lave-linge vous fait consommer 30% d'électricité supplémentaire.
A l'inverse, la faible présence de calcaire dans l'eau donne une eau douce. Une eau trop douce (sans calcaire) présente aussi des inconvénients :
-l'absence de calcaire empêche l'instauration d'une couche carbonatée qui assure aussi la protection des canalisations contre les risques de corrosion. L'eau devient donc agressive.
-Les phénomènes de corrosion, liés aussi au pH (acidité), entraînent donc la solubilisation des métaux, notamment le fer, le cuivre et le plomb et donc la formation de boues métallisées : les circuits fermés d'eau comme le chauffage central ou une tour de refroidissement ou une pompe à chaleur.
Pour connaître l'état de potabilité de l'eau en France
http://www.sante.gouv.fr/qualite-de-l-eau-potable
Tout le monde utilise l'eau. Tous les secteurs industriels et tertiaires utilisent de l'eau. Toutes les eaux sont calcaires sauf l'eau des rivières et l'eau de pluie qui sont par contre chargées en microorganismes et polluants.
 Résistance de cumulus
Résistance de cumulus  Calcaire, rouille, tartre
Calcaire, rouille, tartre
 Tartre, calcaire et rouille
Tartre, calcaire et rouille
 alternance eau douce / eau dure et calcaire
alternance eau douce / eau dure et calcaire
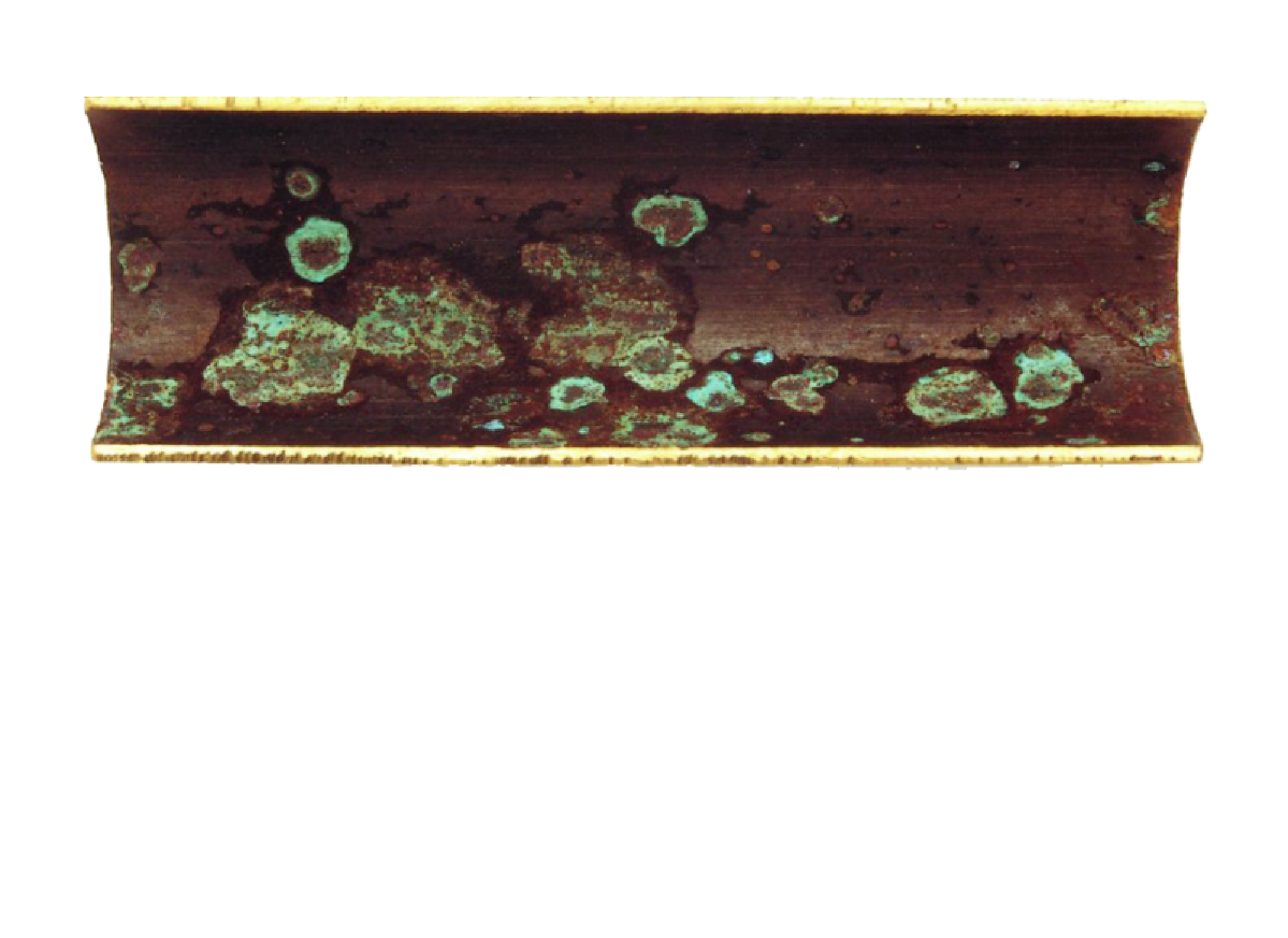
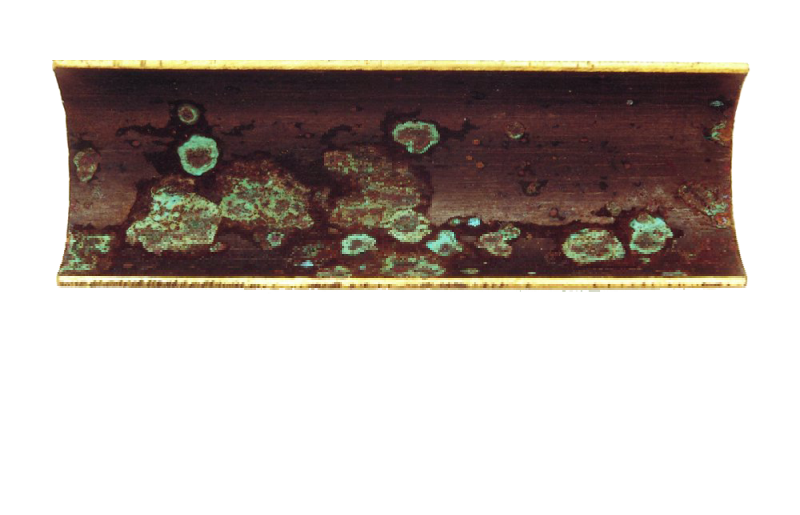 Corrosion du cuivre
Corrosion du cuivre